消毒产品卫生监督检查
一、法规依据
3.《国务院关于加强食品等产品安全监督管理的特别规定》8.《关于印发消毒管理办法有关实施配套文件的通知》(卫法监发(2002)142号)12.《卫生部关于印发健康相关产品命名规定的通知》(卫法监发[2001]109号)13.《卫生部关于同意对经营过期一次性卫生用品按照经营不符合国家卫生标准的卫生用品进行查处的批复》(卫法监发[2001]213号)14.《卫生部关于消毒剂及抗菌卫生用品原料使用有关问题的批复》(卫法监发[2001]288号)15.《卫生部关于进一步规范消毒产品监督管理有关问题的通知》(卫法监发[2003]41号)16.《卫生部关于发布皮肤粘膜消毒剂中部分成分限量值规定的通知》(卫法监发[2003]214号)17.《卫生部法监司关于内窥镜消毒清洗机生产企业监管问题的复函》(卫法监食便函[2003]418号)18.《卫生部关于对<消毒管理办法>有关适用问题的复函》(卫政法函[2004]314号)19.《卫生部关于调整消毒产品监管和许可范围的通知》(卫监督发[2005]208号)20.《健康相关产品国家卫生监督抽检规定》(卫监督发[2005]515号)21.《卫生部关于超越许可范围生产消毒产品适用法律问题的批复》(卫监督发[2007]235号)22.《卫生部关于口腔粘膜消毒产品监管问题的批复》(卫监督发[2008]206号)23.《卫生部关于次氯酸钠类消毒剂产品有效期等监管问题的批复》(卫监督函[2008]512号)24.《卫生部关于消毒产品法律适用问题的批复》(卫监督函[2009]21号)25.《卫生部关于次氯酸钠类消毒剂有关问题的批复》(卫监督函[2009]34号)26.《食品用消毒剂原料(成份)名单(2009版)》27.《取消以次氯酸钠为主要有效成分的消毒剂和以戊二醛为主要有效成分的消毒剂卫生行政许可》(卫生部公告[2010]8号)31.《漂白粉、漂粉精类消毒剂卫生质量技术规范(试行)》32.《生活饮用水消毒剂和消毒设备卫生安全评价规范》(卫法监[2005]336号)33.卫生部公告2004年第13号—取消《消毒管理办法》规定的对卫生用品的备案管理34.《国家卫生计生委关于进一步加强消毒产品事中事后监管的通知》(国卫监督发[2015]90号)35.关于发布强制性卫生行业标准《消毒产品卫生安全评价技术要求》的通告(国卫通〔2018〕18号)36.《国务院关于加强食品等产品安全监督管理的特别规定》(中华人民共和国国务院令第503号)37.国家卫健委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知(国卫办监督函〔2020〕99号)38.国家卫生健康委办公厅关于进一步加强新冠肺炎疫情防控期间消毒产品监管工作的通知(国卫办监督函〔2020〕658号)
消毒产品:
《消毒产品生产企业卫生规范》(2009年版)和《消毒管理办法》规定:消毒产品是指纳入卫生部《消毒产品分类目录》中的产品。包括消毒剂、消毒器械(含生物指示物、化学指示物(灭菌物品包装物)和卫生用品。《消毒产品卫生安全评价规定》(国卫监督发〔2014〕36号)规定:是指具有较高风险,需要严格管理以保证安全、有效的消毒产品,包括用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械,皮肤黏膜消毒剂,生物指示物、灭菌效果化学指示物。《消毒产品卫生安全评价规定》(国卫监督发〔2014〕36号)规定:是指具有中度风险,需要加强管理以保证安全、有效的消毒产品,包括除第一类产品外的消毒剂、消毒器械、化学指示物,以及带有灭菌标识的灭菌物品包装物、抗(抑)菌制剂。《消毒产品卫生安全评价规定》(国卫监督发〔2014〕36号)规定:是指风险程度较低,实行常规管理可以保证安全、有效的除抗(抑)菌制剂外的卫生用品。《新消毒产品和新涉水产品卫生行政许可管理规定》(国卫办监督发〔2014〕14号)规定:新消毒产品是指利用新材料、新工艺技术和新杀菌原理生产的消毒剂和消毒器械。新消毒产品上市前实行卫生行政许可管理,国家卫计委审批,发放卫生行政许可批件。《消毒产品生产企业卫生规范》(2009年版)规定:是指可杀灭一切细菌繁殖体(包括分枝杆菌)、病毒、真菌及其孢子等,并可杀灭大部分细菌芽孢,达到高水平消毒要求的消毒剂。消毒产品卫生安全评价技术要求WS 628—2018规定:消毒产品卫生安全评价是消毒产品生产企业(或委托第三方)对消毒产品有效性和卫生安全性进行的综合评价,评价内容包括产品标签(铭牌)、说明书、检验报告、企业标准或质量标准、生产企业卫生许可证(境外允许生产销售的证明文件及报关单)、消毒剂、指示物和抗(抑)菌制剂的产品配方、消毒器械的结构图等。第一类消毒产品卫生安全评价报告有效期为四年,第二类消毒产品卫生安全评价报告长期有效。三、消毒产品分类目录
《关于印发消毒管理办法有关实施配套文件的通知》(卫法监发(2002)142号)附件3消毒产品分类目录规定:(一)消毒剂类
1、用于医疗卫生用品消毒、灭菌的消毒剂
2、用于皮肤、粘膜消毒的消毒剂(其中用于粘膜消毒剂仅限医疗卫生机构诊疗用)
3、用于餐饮具消毒的消毒剂
4、用于瓜果、蔬菜消毒的消毒剂
5、用于水消毒的消毒剂
6、用于环境消毒的消毒剂
7、用于物体表面消毒的消毒剂
8、用于空气消毒的消毒剂
9、用于排泄物、分泌物等污物消毒的消毒剂
(二)消毒器械类消毒器械
1、用于医疗器械、用品灭菌的灭菌器械
2、用于医疗器械、用品消毒的消毒器械
3、用于餐饮具消毒的消毒器械
4、用于空气消毒的消毒器械
5、用于水消毒的消毒器械
6、用于物体表面消毒的消毒器械生物指示物
1、用于测定压力蒸汽灭菌效果的指示物
2、用于测定环氧乙烷灭菌效果的指示物
3、用于测定紫外线消毒效果的指示物
4、用于测定甲醛灭菌效果的指示物
5、用于测定电离辐射灭菌效果的指示物化学指示物
1、用于测定压力蒸汽灭菌的指示物(包括指示卡、指示胶带、指示标签和BD试纸)
2、用于测定环氧乙烷灭菌的指示物(包括指示卡和指示标签)
3、用于测定紫外线消毒的指示物(包括辐照强度指示卡和消毒效果指示卡)
4、用于测定干热灭菌效果的指示物
5、用于测定电离辐射灭菌效果的指示物
6、用于测定化学消毒剂浓度的指示物灭菌包装物
1、用于压力蒸汽灭菌且带有灭菌标识的包装物
2、用于环氧乙烷灭菌且带有灭菌标识的包装物
3、用于甲醛灭菌且带有灭菌标识的包装物
卫生部规定的纳入消毒剂、消毒器械管理的其他物品(三)卫生用品类
1、妇女经期卫生用品
1)卫生巾(纸,带)
2)卫生护垫
3)卫生栓(内置棉条)
2、尿布等排泄物卫生用品
1)尿裤
2)尿布(垫,纸)
3)隔尿垫
3、皮肤,粘膜卫生用品
1)湿巾(纸)
2)卫生湿巾(纸)
3)抗(抑)菌洗剂(不含栓剂,皂类)
4、隐形眼镜护理用品
1)隐形眼镜护理液
2)隐形眼镜保存液
3)隐形眼镜清洁剂
5、其他的一次性卫生用品
1)纸巾(纸)
2)卫生棉(棒,签,球)
3)化妆棉(纸,巾)
4)手(指)套
5)纸质餐饮具《消毒产品生产企业卫生许可规定》(卫监督发[2009]110号)附件3消毒产品生产类别分类目录规定:( 十六) 用于测定压力蒸汽灭菌效果的生物指示物。( 十七) 用于测定环氧乙烷灭菌效果的生物指示物。( 二十一 ) 用于测定电离辐射灭菌效果的生物指示物。( 二十二 ) 用于测定等离子体灭菌效果的生物指示物。( 二十三 ) 用于测定压力蒸汽灭菌的化学指示物(指示卡、指示胶带、指示标签、 BD 试纸、 BD 包)。( 二十四 ) 用于测定环氧乙烷灭菌的化学指示物(指示卡、指示胶带、指示标签)。( 二十五 ) 用于测定紫外线消毒的化学指示物(辐照强度指示卡、消毒效果指示卡)。( 二十六 ) 用于测定干热灭菌效果的化学指示物。( 二十七 ) 用于测定电离辐射灭菌效果的化学指示物。( 二十八 ) 用于测定化学消毒剂浓度的化学指示物。( 二十九 ) 用于测定等离子体灭菌效果的化学指示物。( 三十) 用于压力蒸汽灭菌且带有灭菌标识的包装物。( 三十一 ) 用于环氧乙烷灭菌且带有灭菌标识的包装物。( 三十二 ) 用于甲醛灭菌且带有灭菌标识的包装物。( 三十三 ) 用于等离子体灭菌且带有灭菌标识的包装物。( 七) 抗(抑)菌制剂(栓剂、皂剂除外)(注明具体剂型)。在国内从事消毒产品生产、分装的单位和个人,必须按照法规规定取得消毒产品生产企业卫生许可证和产品卫生许可证。消毒产品生产企业一个生产场所一证,一个集团或公司拥有多个生产场所的,应分别申请卫生许可证。消毒产品卫生许可包括生产企业卫生许可(即场地许可)和产品卫生许可(即卫生许可批件)。许可批件主要是针对新消毒产品,但是截至目前国家暂未批过新消毒产品。《中华人民共和国传染病防治法》第二十九条第三款规定:生产用于传染病防治的消毒产品的单位和生产用于传染病防治的消毒产品,应当经省级以上人民政府卫生行政部门审批。《国务院对确需保留的行政审批项目设定行政许可的决定》(2004年7月1日国务院令第412号,2009年1月29日国务院令第548号修改,2016年8月25日国务院令671号修改)规定:200:消毒产品生产企业(一次性使用医疗用品的生产企业除外)卫生许可(省级人民政府卫生行政主管部门实施);201:生产消毒剂、消毒器械卫生许可(卫生部实施)。消毒剂、消毒器械和卫生用品生产企业取得工商行政管理部门颁发的营业执照后,还应当取得所在地省级卫生计生行政部门发放的卫生许可证,方可从事消毒产品的生产。注:虽然《行政许可法》规定部门规章不能设定行政许可,但《行政许可法》规定规章可以在上位法设定的行政许可事项范围内,对实施该行政许可作出具体规定。1989年2月21日第七届全国人民代表大会常务委员会第六次会议通过《传染病防治法》(2004年8月28日第十届全国人民代表大会常务委员会第十一次会议修订;根据2013年6月29日第十二届全国人民代表大会常务委员会第三次会议《关于修改〈中华人民共和国文物保护法〉等十二部法律的决定》修正)。首次规定了生产用于传染病防治的消毒产品的单位和生产用于传染病防治的消毒产品,应当经省级以上人民政府卫生行政部门审批。1992年8月31日卫生部令第22号发布了《消毒管理办法》(2002年废止),规定了国家对生产、经营、使用消毒药剂、消毒器械和一次性使用的医疗、卫生用品实行卫生许可证制度。2002年3月28日卫生部令第27号公布了新的《消毒管理办法》(根据2016年1月19日国家卫生和计划生育委员会令第8号《国家卫生计生委关于修改〈外国医师来华短期行医暂行管理办法〉等8件部门规章的决定》第一次修正;根据2017年12月26日国家卫生和计划生育委员会令第18号《国家卫生计生委关于修改〈新食品原料安全性审查管理办法〉等7件部门规章的决定》第二次修正),明确规定了消毒剂、消毒器械、卫生用品和一次性使用医疗用品的生产企业应当取得所在地省级卫生行政部门发放的卫生许可证后,方可从事消毒产品的生产;卫生用品和一次性使用医疗用品在投放市场前应当向省级卫生行政部门备案;生产消毒剂、消毒器械应当按照本办法规定取得卫生部颁发的消毒剂、消毒器械卫生许可批件。2002年6月4日卫生部下发了关于印发修订后的《消毒管理办法》有关实施配套文件的通知(卫法监发[2002]142号),岀台了《消毒产品分类目录》《卫生用品和一次性使用医疗用品备案管理规定》《消毒产品生产企业、消毒服务机构卫生许可证申报与受理规定》《消毒剂、消毒器械卫生许可批件申报与受理规定》。对上述消毒产品的备案和生产企业卫生许可及消毒产品卫生许可批件作岀了明确规定。2003年11月14日卫生部公告第24号将一次性使用医疗用品不再纳入《消毒管理办法》管理,自公告发布之日起,取消卫生行政部门对一次性使用医疗用品的备案制度和对一次性使用医疗用品生产企业的卫生许可制度。2005年5月30日,卫生部下发《关于调整消毒产品监管和许可范围的通知》(卫监督发[2005]208号),不再将专用于人体足部、眼睛、指甲、腋部、头皮、头发、鼻粘膜等特定部位的具有消毒或抗(抑)菌功能的产品及口罩和避孕套纳入消毒产品进行受理、审批和监管。取消了紫外线杀菌灯、食具消毒柜、压力蒸汽灭菌器、75%单方乙醇消毒液的卫生许可。需要注意的是该文件取消的是产品的卫生许可,但是,上述四种消毒产品生产企业的卫生许可证并没有取消。文件同时要求上述产品的生产企业要在取得生产企业卫生许可证的基础上,按照相关法规、标准和规范生产。2010年卫生部制定了《消毒产品卫生安全评价规定》(2010年版),规定了紫外线杀菌灯、食具消毒柜(限于符合《食具消毒柜安全和卫生要求》GB17988)、压力蒸汽灭菌器、75%单方乙醇消毒液、符合《次氯酸钠类消毒剂卫生质量技术规范》和《戊二醛类消毒剂卫生质量技术规范》的产品、抗(抑)菌制剂七类消毒产品不需要取得产品卫生许可,但上述产品首次上市前应进行卫生安全评价。2014年国家卫计委印发了《消毒产品卫生安全评价规定》(2014年版),对消毒产品取消了行政许可,但生产企业(场地)仍然实行行政许可。规定第一、二类消毒产品首次上市前应进行卫生安全评价(委托第三方或者自行评价),并向所在地市级卫生计生行政部门备案。但是,对于“三新产品”仍然实行“双许可”。2013年9月4日国家卫生计生委下发《关于加快政府职能转变深化行政审批制度改革的意见(国卫法制发〔2013〕16号)》,2014年12月22日山东省卫计委下发了《关于加强省级下放卫生计生审批许可事项管理监督工作的通知(鲁卫监督发﹝2014﹞3号)》,将消毒产品生产企业卫生行政审批许可事项下放到设区市卫生计生行政部门。2015年10月30日,国家卫计委关于进一步加强消毒产品事中事后监管的通知(国卫监督发〔2015〕90号)取消发放备案凭证,但是备案并没有取消。2020年2月3日,国家卫健委办公厅下发了关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知(国卫办监督函【2020】99号)。文件明确规定了为保障全国消毒剂的有效供给,醇类、含氯、二氧化氯、过氧乙酸四类消毒剂可紧急上市,上述紧急上市消毒剂的国内生产企业应当取得消毒产品生产企业卫生许可证。在产品上市销售前,应当及时向属地消毒产品备案部门提交消毒剂标签说明书和产品质量安全承诺书(附消毒剂有效成分含量和pH检测合格报告)。与已备案产品同类的进口消毒剂,在华责任单位向属地消毒产品备案部门提交产品质量安全承诺书(附国外产品上市证明文件和检验报告)后,可先行上市销售使用,不需要提报卫生安全评价报告备案。上述紧急上市消毒剂在上市销售使用的同时,产品责任单位应当按照WS628-2018《消毒产品卫生安全评价技术要求》的检验项目进行检测,并按规定进行备案。新型冠状病毒感染的肺炎疫情防控应急响应结束后,产品责任单位未完成检验和备案的,应当立即停止生产销售上述紧急上市消毒剂。有继续生产销售意愿的,应当按照原有正常程序办理相关手续,否则将按照《传染病防治法》、《消毒管理办法》等有关规定严肃查处。4.1如果《消毒产品分类目录》和《医疗器械分类目录》中的产品有重复的,首先应该看该产品是否属于“用于传染病防治的消毒产品”。如果属于则为卫生健康行政部门许可。因其设定的依据是《传染病防治法》,属上位法,位阶高于《医疗器械监督管理条例》。否则,属市场监管部门许可。如何判定“用于传染病防治”,目前还没有相关具体办法,国家卫健委也暂时没有相关文件予以规定,个人理解消毒剂、消毒器械应该纳入“用于传染病防治的消毒产品”。 4.2《消毒产品分类目录》中的纸质餐饮具,目前《食品安全法》对食品相关产品有明确规定,且《食品相关产品生产许可证许可目录》里面有“纸板餐具”。根据“上位法优于下位法”的原则,因此,纸质餐饮具当不属于卫生行政许可范畴。在中华人民共和国境内生产、经营和使用的除新消毒产品以外的第一类、第二类消毒产品(消毒剂、消毒器械、指示物、抗(抑)菌制剂)首次上市前,依据WS 628-2018《消毒产品卫生安全评价技术要求》自行或者委托第三方进行卫生安全评价,并对评价结果负责。卫生安全评价合格并在“全国消毒产品网上备案信息服务平台”完成备案的消毒产品方可上市销售。第一类、第二类消毒产品首次上市时,产品责任单位应当将卫生安全评价报告报市级卫生健康行政部门进行备案(备案凭证取消)。国家卫健委办公厅关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知(国卫办监督函【2020】99号)规定:2.1醇类消毒剂、含氯消毒剂、二氧化氯消毒剂、过氧乙酸消毒剂四类消毒剂产品在产品上市销售前,应当及时向属地消毒产品备案部门提交消毒剂标签说明书和产品质量安全承诺书(附消毒剂有效成分含量和pH检测合格报告)。2.2消毒剂在上市销售使用的同时,产品责任单位应当按照WS628-2018《消毒产品卫生安全评价技术要求》的检验项目进行检测,并按规定进行备案。新型冠状病毒感染的肺炎疫情防控应急响应结束后,产品责任单位未完成检验和备案的,应当立即停止生产销售上述紧急上市消毒剂。有继续生产销售意愿的,应当按照原有正常程序办理相关手续,否则将按照《传染病防治法》、《消毒管理办法》等有关规定严肃查处。注:国家卫生健康委办公厅关于进一步加强新冠肺炎疫情防控期间消毒产品监管工作的通知(国卫办监督函〔2020〕658号)规定:为保障新冠肺炎疫情初期消毒剂的有效供给,我委印发了《关于部分消毒剂在新型冠状病毒感染的肺炎疫情防控期间紧急上市的通知》(国卫办监督函〔2020〕99号,以下简称《通知》),为各地疫情防控工作提供有力支撑。目前,新冠肺炎疫情防控工作已从应急状态转为常态化,部分地区消毒剂供应紧张问题得到缓解。各地应当全面落实“外防输入、内防反弹”的总体防控策略,充分认识疫情防控工作的复杂性和长期性,根据《通知》要求,结合本地疫情防控工作实际和消毒产品市场供需情况,可及时调整在新冠肺炎疫情防控期间紧急上市消毒剂的监管措施。自本文印发之日起,省级卫生健康行政部门停止实施《通知》中消毒剂的紧急上市措施,按照《国家卫生计生委关于印发消毒产品卫生安全评价规定的通知》(国卫监督发〔2014〕36号)要求,做好消毒产品的网上备案及信息公开工作。有继续生产销售已紧急上市消毒剂意愿的消毒产品责任单位,应当按照《国家卫生计生委关于印发消毒产品卫生安全评价规定的通知》要求,完成已紧急上市消毒剂的卫生安全评价并备案。截至2020年12月31日,消毒产品责任单位未按照原有正常程序完成已紧急上市消毒剂的卫生安全评价和备案的,应当立即停止生产销售上述已紧急上市消毒剂。1.生产布局必须符合生产工艺流程,厂区应具备生产车间、辅助用房、质检用房、物料和成品仓储用房等,且衔接合理。生产车间使用面积应不小于100平方米,其中分装企业生产车间使用面积应不小于60平方米;生产车间净高不低于2.5米。3.仓库应当有通风,防尘,防鼠,防虫等设施,储物存放保持干燥、清洁、整齐,应当符合产品相应的保存要求。4.卫生用品应当离地、离墙存放不小于10厘米,离顶不小于50厘米。5.待检产品、合格产品、不合格产品应分开存放,并有易于识别的明显标记。6.产品出入库应当有登记、验收制度,并记录备查。(二)产品投放市场前的要求1.第一类、第二类消毒产品(消毒剂、消毒器械、指示物、抗(抑)菌制剂)首次上市前,依据WS 628-2018《消毒产品卫生安全评价技术要求》应当自行或者委托第三方进行卫生安全评价,并对评价结果负责。卫生安全评价合格并在“全国消毒产品网上备案信息服务平台”完成备案的消毒产品方可上市销售。2.在产品上市销售前,应当及时向属地消毒产品备案部门提交消毒剂标签说明书和产品质量安全承诺书(附消毒剂有效成分含量和pH检测合格报告)。3.每批产品投放市场前,生产企业应按《消毒管理办法》第十九条、《消毒产品生产企业卫生规范》第四十二条和《消毒产品卫生安全评价技术要求》(WS 628—2018)规定的要求对消毒剂、消毒器械、生物指示物、化学指示物、带有灭菌标识的灭菌物品包装物进行卫生质量检验,合格后方可出厂,并对产品的真实性负责。上市后的消毒产品有以下情形改变的,产品责任单位应对相关检验项目重新检测:3.1实际生产地址迁移、另设分厂或车间、转委托生产加工的,消毒剂和抗(抑)菌制剂应进行有效成分含量、原液稳定性试验、pH 值测定;消毒器械应进行主要杀菌因子强度测定,不具备杀菌因子测定条件的应进行模拟现场试验;生物指示物应进行含菌量测定,化学指示物应进行颜色变化情况测定,带有灭菌标识的灭菌物品包装物应进行灭菌因子穿透性能测定。3.2消毒剂、抗(抑)菌制剂、生物指示物、化学指示物、带有灭菌标识的灭菌物品包装物及 PCD延长产品有效期的,消毒剂和抗(抑)菌制剂应进行有效成分含量、pH 值、一项抗力最强的微生物杀灭(或抑制)试验和稳定性试验;使用原送检样品的应做稳定性试验。生物指示物、化学指示物、PCD 应进行稳定性试验;带有灭菌标识的灭菌物品包装物应进行包装材料有效期试验。3.3消毒剂、消毒器械和抗(抑)菌制剂增加使用范围或改变使用方法的,应进行相应的理化、微生物杀灭(或抑制)和毒理试验。3.4第一类消毒产品卫生安全评价报告四年有效期满前的,消毒剂应进行有效成分含量、pH 值和一项抗力最强的微生物杀灭试验,消毒器械应进行主要杀菌因子强度和一项抗力最强的微生物杀灭试验,生物指示物应进行含菌量的测定,灭菌效果化学指示物应进行颜色变化情况的测定。委托检验的,应按照《消毒产品生产企业卫生规范》第四十二条的规定,符合以下要求:1.生产企业有微生物检验条件的可以接受其分装企业、另设分厂(车间)的委托,对产品微生物指标进行检验;生产企业无微生物检验条件的应委托通过实验室资质认定的检验机构对产品微生物指标进行检验;消毒剂、抗、抑菌制剂有效成分含量检测需要使用气相色谱、高效液相色谱等仪器设备的,可委托通过计量认证的检验机构进行检验。3.检验机构承担的委托检验项目应取得实验室资质认定(计量认证)资格 。1.灭菌剂、皮肤粘膜消毒剂和抗(抑)菌制剂的生产用水应符合纯化水要求;2.其他消毒剂、卫生用品的生产用水应符合《生活饮用水卫生标准》(GB5749)的要求。1.原材料应无毒、无害、无污染;原材料包装应清洁,清楚标明内含物的名称、生产单位、生产日期或生产批号;影响卫生质量的原材料不应裸露;有特殊要求的原材料应标明保存条件和保质期;2.对影响产品卫生质量的原材料应有相应的检验报告或证明材料,必要时需进行微生物监控和采取相应措施;企业应当建立完善产品生产的卫生质量保证体系,产品企业标准或者质量标准中的卫生指标及检验方法应当符合国家有关卫生标准、技术规范的要求,应当建立自检制度,具备相应的检验仪器、设备。用于生产与检验的计算器具应按要求定期检定,记录备查。产品质量检测记录及报告应当完整,不得随意涂改, 生产过程的各项原始记录应当妥善保存,保存期限为该产品的失效日期后三个月。直接从事消毒产品生产的操作人员,上岗前及每年必须进行一次健康体检,取得健康体检合格证明后方可上岗。按照《消毒产品标签说明书管理规范》的要求进行标注。具体标注内容如下:产品商标已注册者应标注“##®”;产品商标申请注册者应标注“##TM”;其余产品应标注“##牌”。
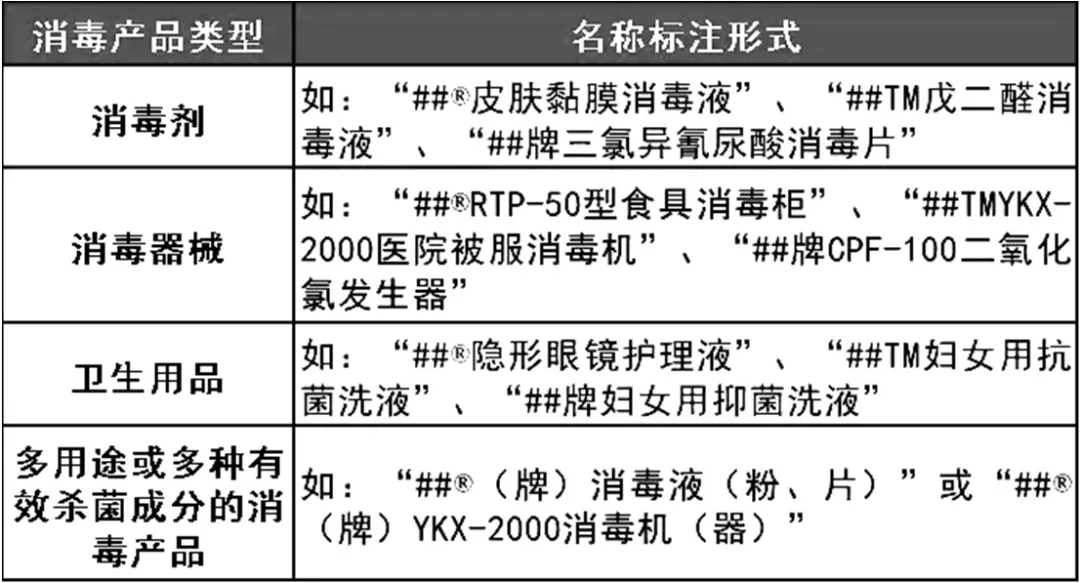

“××药物卫生巾”、“××消毒湿巾”、“××抗菌卫生湿巾”、“湿疣外用消毒杀菌剂”、“××白斑净”、“××灰甲灵”、“××鼻康宁”、“××除菌洗手液”、“全能多功能护理液”、“××全功能保养液”和“××速效杀菌全护理液”、 ××滴眼露”、“××眼部护理液”等等。2.1消毒剂、抗(抑)菌剂的剂型如:“液体”、“片剂”、“粉剂”等等;禁止标注栓剂、皂剂。2.2消毒器械的型号如“RTP-50(型)” 等。
注意:消毒产品禁止标注抗生素、激素等禁用成分,如“甲硝唑”、“肾上腺皮质激素”等等。
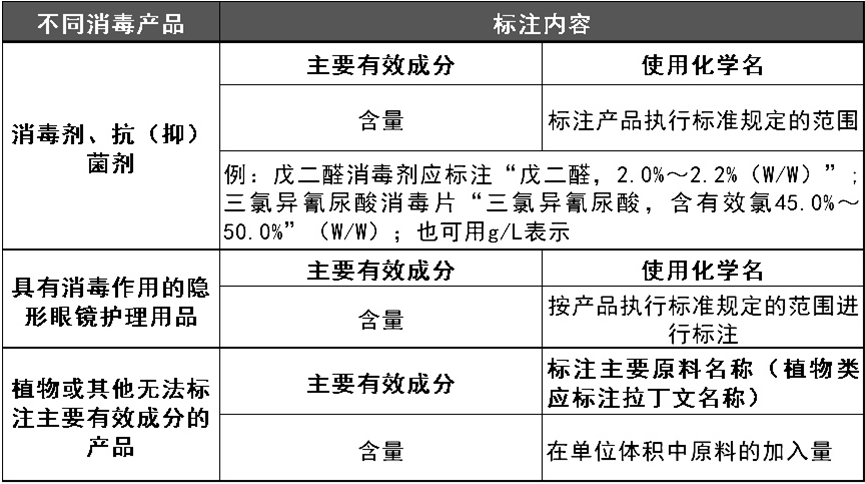
4.1定义:指产品及其生产企业经省级以上卫生行政部门批准的文号。4.1生产企业卫生许可证号:“(省、自治区、直辖市简称)卫消证字(发证年份)第XXXX号”;4.2产品卫生许可批件号:“卫消字(年份)第XXXX号”、“卫消进字(年份)第XXXX号”。注意:不得标注无效批准文号,如:(1996)×卫消准字第XXXX号。产品执行标准应为现行有效的标准,以标准的编号表示,如“GB15979”、“Q/HJK001”等,可不标注标准的年代号。企业标准应符合国家相关法规、标准和规范的要求。对指示微生物具有抑制、杀灭作用的,应在产品说明书中标注对其代表的微生物种类有抑制、杀灭作用。例如对金黄色葡萄球菌杀灭率≥99.999%,可标注“对化脓菌有杀灭作用”;对脊髓灰质炎病毒有灭活作用,可标注“对病毒有灭活作用”;6.2.1各种疾病名称和疾病症状,如“牛皮癣”、“神经性皮炎”、“脂溢性皮炎”等。6.2.2无检验依据的抑/杀微生物类别,如“尖锐湿疣病毒”、“非典病毒”等。7.1使用方法:明确、详细;使用方法二种以上的,建议用表格表示。7.2消毒剂、抗(抑)菌剂、隐形眼镜护理用品应标注作用对象,作用浓度(用有效成分含量表示)和配制方法、作用时间(以抑菌环试验为检验方法的可不标注时间)、作用方式、消毒或灭菌后的处理方法。用于粘膜的消毒剂应标注“仅限医疗卫生机构诊疗用”内容。例如:戊二醛消毒液的使用范围“适用于医疗器械的消毒、灭菌”;使用方法“①使用前加入本品附带的A剂(碳酸氢钠),充分搅匀溶解;再加入附带的B剂(亚硝酸钠)溶解混匀。②消毒方法:用原液擦拭、浸泡消毒物品20min~45min。③灭菌方法:用原液浸泡待灭菌物品10h。④消毒、灭菌的医疗器械必须用无菌水冲洗干净后方可使用”。7.3消毒器械应标注作用对象,杀菌因子强度、作用时间、作用方式、消毒或灭菌后的处理方法。例如食具消毒柜的使用范围“餐(饮)具的消毒、保洁”;使用方法“将洗净沥干的食具有序地放在层架上;按电源和消毒键,指示灯同时启亮;作用一个周期后,消毒指示灯灭,表示消毒结束。”注意:使用方法中禁止标注无检验依据的使用对象、与药品类似用语、无检验依据的使用剂量及对象,如“每日X次”,“XX天为一疗程,或遵医嘱”等等。本项内容包括产品保存条件、使用防护和使用禁忌。对于使用中可能危及人体健康和人身、财产安全的产品,应当有警示标志或者中文警示说明。9.1生产日期应按“年、月、日”或“20050903”方式表示。9.2保质期、有效期应按“X年或XX个月”方式表示。生产批号形式由企业自定。限期使用日期应按“请在XXXX年XX月前使用”或“有效期至XXXX年XX月”等方式表示。本项内容应标注消毒器械产生杀菌因子的元器件的使用寿命或更换时间。使用寿命应按“X年或XXXX小时”等方式表示。12.1生产企业名称、地址应与其消毒产品生产企业卫生许可证一致。12.2委托生产加工:需同时标注产品责任单位(委托方)名称、地址和实际生产加工企业(被委托方)的名称及卫生许可证号。12.3不属于委托生产加工,但产品责任单位与实际生产加工企业信息不同:分别标注产品责任单位信息和实际生产加工企业信息。例如责任单位为总公司,实际生产加工企业为其下属某个企业。根据《消毒产品卫生安全评价规定》第十五条的规定:产品经营、使用单位在经营、使用第一类、第二类消毒产品前,应当索取卫生安全评价报告和备案凭证复印件( 备案凭证已取消)。卫生安全评价报告中的评价资料包括标签(铭牌)、说明书、检验报告结论、国产产品生产企业卫生许可证、进口产品生产国(地区)允许生产销售的证明文件及报关单。注意:国家卫生计生委已经于2016年年底取消了(国家卫生计生委关于进一步加强消毒产品事中事后监管的通知(国卫监督发〔2015〕90号) )。所以,消毒产品经营单位的索证工作,只需要按照上面的要求,索取卫生安全评价报告中的部分资料就可以。第一类、第二类消毒产品应重点检查是否持有效的生产企业卫生许可证,核查生产企业实际生产地址、生产方式、生产项目、生产类别以及法定代表人或负责人、注册地址是否与生产企业卫生许可证注明的一致;检查卫生许可证是否在有效期限内,核查卫生许可证有无涂改、转让、伪造、出租、出借等情况;注:《国家卫生计生委关于进一步加强消毒产品事中事后监管的通知》(国卫监督发[2015]90号)规定:进一步简化程序,方便企业,取消消毒产品卫生安全评价报告备案凭证。省级卫生计生行政部门要正确认识备案为告知、备而待查性质,不属于行政审批。对备案资料齐全的要按规定备案。各级各类医疗卫生机构和经营企业在购进和使用第一类、第二类消毒产品时,不应再要求产品责任单位提供卫生安全评价报告备案凭证。对不需要取得卫生安全评价报告的第三类消毒产品,检查其是否持有效的消毒产品生产企业卫生许可证。注:卫生部公告2004年第13号(2004.6.29)规定:取消卫生用品的备案管理。卫生用品在投放市场前不再需要向卫生行政部门申请备案。今后各级卫生行政部门要依据《消毒管理办法》加强对卫生用品的市场监管,并做好对卫生用品生产企业的卫生许可和监管工作。检查新消毒产品是否具有有效的生产企业卫生许可证和产品卫生许可批件,核实产品卫生许可批件标注的生产企业地址与生产企业卫生许可证上注明的是否一致;对委托生产加工的,核实产品卫生许可批件标注的实际生产企业地址与生产企业卫生许可证上注明的是否一致。2.1现场检查生产企业的厂区布局、生产区、生产设备和检验设备等生产条件是否符合《消毒产品生产企业卫生规范(2009版)》的要求。2.2现场检查是否擅自改变经核准的生产工艺、生产车间布局等。2.3必要时可根据实际情况对生产环境、生产用水的卫生质量进行现场采样、监测。3.1现场检查生产的各项标准操作规程和管理制度执行情况。3.2现场检查生产过程各项记录是否完整、是否可保证溯源、有无随意涂改,是否妥善保存至产品有效期后3个月。3.3现场检查生产过程中是否添加卫计委规定的禁用物质。4.1检查消毒剂所用原料名称、规格、等级及其原料所用量是否与批准时配方中的相符。4.2检查第一类、第二类消毒产品所用原料名称、CAS号、原料商品名称、原料含量、等级及其原料所用量是否与该产品《卫生安全评价报告》附件1配方中的相符。4.3检查食品消毒剂的原料是否符合《食品用消毒剂原料(成份)名单(2009版)》的要求。4.4检查其他卫生用品是否索取无毒、无害、无污染的相应检验报告或证明材料,原材料是否与生产产品的配方组分、规格、等级要求相符。4.5检查消毒产品原料库是否有国家卫生健康行政部门规定的禁用物质。4.6检查消毒产品使用原料的采购记录、入库登记、检验报告或相应的产品质量证明材料以及原料出入库记录是否完整。4.7检查消毒产品生产企业是否将禁止使用的抗生素、抗真菌药物、激素添加到原料中使用或将违禁物质作为原料使用。对生产企业消毒产品出厂检验报告,出厂检验项目、检验频次和检验结果进行监督检查,查看是否符合《消毒产品生产企业卫生规范(2009年版)》和《消毒产品卫生安全评价技术要求》(WS 628—2018)及产品企业标准的规定。对委托检验的企业,还应检查检验机构的合法资质及委托检验协议书;检查需要进行卫生安全评价的消毒剂、消毒器械和抗(抑)菌制剂是否具有符合《消毒产品卫生安全评价规定》的卫生安全评价报告;对生产、经营和使用单位的消毒产品进行监督检查,检查产品卫生质量是否符合国家有关标准、规范和规定。必要时对消毒产品进行监督抽检,但必须符合国家相关规定要求。检查消毒产品标签说明书标注的内容是否符合《消毒管理办法》《消毒产品标签说明书管理规范》及相关标准、规范和规定的要求。重点检查以下内容:6.2检查标注的内容是否存在虚假夸大、明示或暗示对疾病的治疗作用和效果的内容;6.5检查标注的主要原料有效成分含量是否符合该产品执行标准规定的范围、植物成分的检查主要植物拉丁文名称等内容是否完整;6.6检查标注的抑/杀微生物类别、使用范围、使用剂量、使用方法、消毒剂或卫生用品的有效期或保质期以及消毒器械的主要元器件使用寿命等内容是否有相应的有效检验报告等;6.7检查是否标注无效的生产企业卫生许可证号、产品卫生许可批件号、执行标准号;其中,企业标准应依法备案,其内容应符合国家卫生计生委有关要求。6.8检查标注的注意事项、生产日期和有效期(卫生用品为保质期)或者生产批号,生产企业名称、地址、联系方式等内容是否完整。7.1仓储区应保持清洁和干燥,有通风、防尘、防鼠、防虫等设施,并有堆物垫板,货物架等。其中挥发性原材料储存时还应注意避免污染其他原材料;7.2易燃、易爆的消毒产品及其原材料的验收、储存、保管、领用要严格执行国家有关的规定。仓储应符合防雨、防晒、防潮等要求;7.3通风、温度、相对湿度等的控制应满足仓储物品的存储和卫生要求;7.5储物存放应离地、离墙存放不小于10厘米、离顶不小于50厘米。7.7待检产品、合格产品、不合格产品应分开存放,有易于识别的明显标志。8.1检查直接从事消毒产品生产的操作人员,上岗前及每年是否进行一次健康体检,是否取得健康体检合格证明后上岗;检查患有活动性肺结核、甲型和戊型病毒性肝炎、肠道传染病患者及病原携带者、化脓性或慢性渗出性皮肤病、手部真菌感染性疾病的工作人员,治愈前是否从事消毒产品的生产、分装或质量检验工作;8.2检查洁净生产车间和普通生产车间生产过程中人员的卫生状况是否符合要求。8.3检查生产操作人员和检验人员上岗前是否经过消毒产品相关知识的培训,合格上岗。对于经检验不符合国家卫生标准和卫生规范的,或者存在《消毒产品卫生安全评价规定》第十七条规定的七种情形的,可依据《中华人民共和国传染病防治法》第七十三条第三项或者《消毒管理办法》第四十三条的规定对生产企业或者产品责任单位进行查处。对于违法添加抗生素、抗真菌药物、激素等物料的抗抑菌制剂、消毒剂,依据《卫生部关于消毒产品法律适用问题的批复》(卫监督函〔2009〕21号),适用《国务院关于加强食品等产品安全监督管理的特别规定》(国务院令第503号),严厉查处违法添加行为。基层部门缺乏相关检验技术,很难发现违法添加行为。1.3.1外在特征不符合或者无法判定是否符合药品的法定特征的,但是存在宣传内容不真实,暗示对疾病的治疗效果,或者违反《消毒产品标签说明书管理规范》的其他相关规定的,以违反《消毒管理办法》第三十一条第一、二款的规定,依据《消毒管理办法》第四十三条对销售者进行处罚,同时,根据《消毒产品卫生监督工作规范》第二十八条的规定,及时向消毒产品的产品责任单位所在地的卫生计生行政部门或卫生监督机构通报情况。1.3.2 产品本身标签说明书符合要求,但是销售单位夸大宣传,或者网络、网店、微信公众号等进行违法宣传的,依据《卫生部关于对<消毒管理办法>有关适用问题的复函》(卫政法函〔2004〕317号) 规定“如果经销商违规宣传,可以对经销商进行处罚”,适用《消毒管理办法》第四十三条的规定处罚销售者,同时发函给消毒产品的产品责任单位所在地的卫生计生行政部门或卫生监督机构协查。要注意收集违规宣传的证据,比如经当事人确认的网页截图、现场宣传画册、宣传图片等。1.4.1标注虚假、无效证号或者未标注相关批准文号的消毒产品,如果涉及冒充药品行为,可依据《关于进一步开展整治非药品冒充药品专项行动的通知》(国食药监稽〔2010〕204号)、《关于开展非药品冒充药品整治行动的公告》“对未标示产品批准文号以及标示虚假、无效批准文号的产品冒充药品的,一律由食品药品监管部门按照假药依法查处”的规定移交处理。1.4.2标注虚假、无效证号或者未标注相关批准文号的消毒产品,产品标签说明书不涉及冒充药品的,如经查实生产经营无生产企业卫生许可证消毒产品的,以违反《消毒管理办法》第三十二条第一项的规定,依据《消毒管理办法》第四十三条处罚。应注意如确认不属于消毒产品的,则不适用《消毒管理办法》,应以假冒伪劣商品,可移交市场监管部门查处。1)消毒产品生产企业未取得有效的卫生许可证而生产消毒产品的法律适用:《传染病防治法》第二十九条第三款 生产用于传染病防治的消毒产品的单位和生产用于传染病防治的消毒产品,应当经省级以上人民政府卫生行政部门审批。具体办法由国务院制定。《消毒管理办法》第二十条 消毒剂、消毒器械和卫生用品生产企业取得工商行政管理部门颁发的营业执照后,还应当取得所在地省级卫生计生行政部门发放的卫生许可证,方可从事消毒产品的生产。《消毒产品生产企业卫生许可规定》第二条 在国内从事消毒产品生产、分装的单位和个人,必须按照本规定要求申领《消毒产品生产企业卫生许可证》(以下简称卫生许可证)。《中华人民共和国传染病防治法》第七十三条 违反本法规定,有下列情形之一,导致或者可能导致传染病传播、流行的,由县级以上人民政府卫生行政部门责令限期改正,没收违法所得,可以并处五万元以下的罚款;已取得许可证的,原发证部门可以依法暂扣或者吊销许可证;构成犯罪的,依法追究刑事责任:(三)用于传染病防治的消毒产品不符合国家卫生标准和卫生规范的。2)第一类、第二类消毒产品首次上市前未进行卫生安全评价的法律适用:《消毒产品卫生安全评价规定》第四条 产品责任单位应当在第一类、第二类消毒产品首次上市前自行或者委托第三方进行卫生安全评价,并对评价结果负责。卫生安全评价合格的消毒产品方可上市销售。《消毒产品卫生安全评价规定》第十七条 有下列情形之一的,属于不符合国家卫生标准、卫生规范要求或卫生质量不合格的情形,依据《中华人民共和国传染病防治法》第七十三条或《消毒管理办法》第四十四条进行处理:(一)第一类、第二类消毒产品首次上市前未进行卫生安全评价的。《消毒管理办法》第四十四条 消毒产品生产经营单位违反本办法第三十一条、第三十二条规定的,由县级以上地方卫生计生行政部门责令其限期改正,可以处5000元以下罚款;造成感染性疾病暴发的,可以处5000元以上20000元以下的罚款。《消毒产品生产企业卫生规范(2009版)》第二章、第三章、第四章、第五章及其现场监督审核表中的关键项关于开展消毒产品标签说明书专项整治的通知(鲁卫监〔2010〕18号)对监督检查中发现的违法、违规行为,要严格依照有关法律法规,进行行政处罚,对以下违法行为,按如下原则处理。 (一)生产企业不再符合《消毒产品生产企业卫生规范》规定的条件、要求,继续从事消毒产品的生产经营活动的,按照《国务院关于加强食品等产品安全监督管理的特别规定》第三条第三款的规定,由省卫生厅吊销卫生许可证,并公告《国务院关于加强食品等产品安全监督管理的特别规定》第三条生产经营者不再符合法定条件、要求,继续从事生产经营活动的,由原发证部门吊销许可证照,并在当地主要媒体上公告被吊销许可证照的生产经营者名单;构成非法经营罪或者生产、销售伪劣商品罪等犯罪的,依法追究刑事责任。《消毒产品生产企业卫生规范(2009年)》第三十条、第三十七条、第三十八条和第三十九条5)消毒产品生产企业产品投放市场前未按规定进行卫生质量出厂检验或监督抽检消毒产品卫生质量不符合要求的法律适用:《消毒管理办法》第十九条 消毒产品的生产应当符合国家有关规范、标准和规定,对生产的消毒产品应当进行检验,不合格者不得出厂。《消毒管理办法》第三十二条 禁止生产经营下列消毒产品:(一)无生产企业卫生许可证或新消毒产品卫生许可批准文件的;(二)产品卫生安全评价不合格或产品卫生质量不符合要求的。《消毒管理办法》第四十四条 消毒产品生产经营单位违反本办法第三十一条、第三十二条规定的,由县级以上地方卫生计生行政部门责令其限期改正,可以处5000元以下罚款;造成感染性疾病暴发的,可以处5000元以上20000元以下的罚款。6)产品配方与产品卫生安全评价报告中不相符的法律适用:《消毒管理办法》第十九条 消毒产品的生产应当符合国家有关规范、标准和规定,对生产的消毒产品应当进行检验,不合格者不得出厂。《消毒管理办法》第三十二条 禁止生产经营下列消毒产品:(一)无生产企业卫生许可证或新消毒产品卫生许可批准文件的;(二)产品卫生安全评价不合格或产品卫生质量不符合要求的。《消毒管理办法》第四十四条 消毒产品生产经营单位违反本办法第三十一条、第三十二条规定的,由县级以上地方卫生计生行政部门责令其限期改正,可以处5000元以下罚款;造成感染性疾病暴发的,可以处5000元以上20000元以下的罚款。7)消毒产品标签说明书不符合国家卫计委相关规定的法律适用:《消毒管理办法》第三十一条 消毒产品的命名、标签(含说明书)应当符合国家卫生计生委的有关规定。消毒产品的标签(含说明书)和宣传内容必须真实,不得出现或暗示对疾病的治疗效果。《消毒产品标签说明书管理规范》 第一条至第二十一条卫生部关于印发《消毒产品标签说明书管理规范》的通知(卫监督发[2005]426号)规定:对于违反本规范的行为,应按照违反《消毒管理办法》第三十三条的规定,依据第四十七条查处。《消毒管理办法》第四十四条 消毒产品生产经营单位违反本办法第三十一条、第三十二条规定的,由县级以上地方卫生计生行政部门责令其限期改正,可以处5000元以下罚款;造成感染性疾病暴发的,可以处5000元以上20000元以下的罚款。1.对于产品首次上市前未进行卫生安全评价、伪造卫生安全性评价报告、评价结果显示产品不符合要求仍上市的产品,以及未按要求进行每批次卫生质量检验的产品,卫生健康行政部门应按照产品不符合国家卫生标准和卫生规范或产品卫生质量不符合要求进行查处,可依据《消毒管理办法》第四十四条进行处罚;其中用于传染病防治的消毒产品,导致或者可能导致传染病传播流行的,可依据《中华人民共和国传染病防治法》第七十三条进行处罚。2.在经营、使用单位抽检产品卫生质量检测结果或标签说明书不合格的,应当责令立即停止销售、使用,可依据《消毒管理办法》第四十四条进行处罚。非本辖区内生产企业的产品,也可向不合格产品生产企业或在华责任单位所在地的卫生健康行政部门或卫生监督机构发函协查;经营单位违规宣传的,可依据《消毒管理办法》第四十四条进行处罚。
(仅供内部学习交流,如有不妥,欢迎批评指正)